Les molécules : Introduction
Une molécule est un assemblement d’atomes, reliés les uns aux autres comme des wagons de train. Si vous n’avez pas encore vu ce qu’est un atome je vous renvoi à l’article dédié ici et sinon quelques rappels seront donnés au fur et à mesure.
Dans l'EPISODE PRECEDENT SUR LES ATOMES
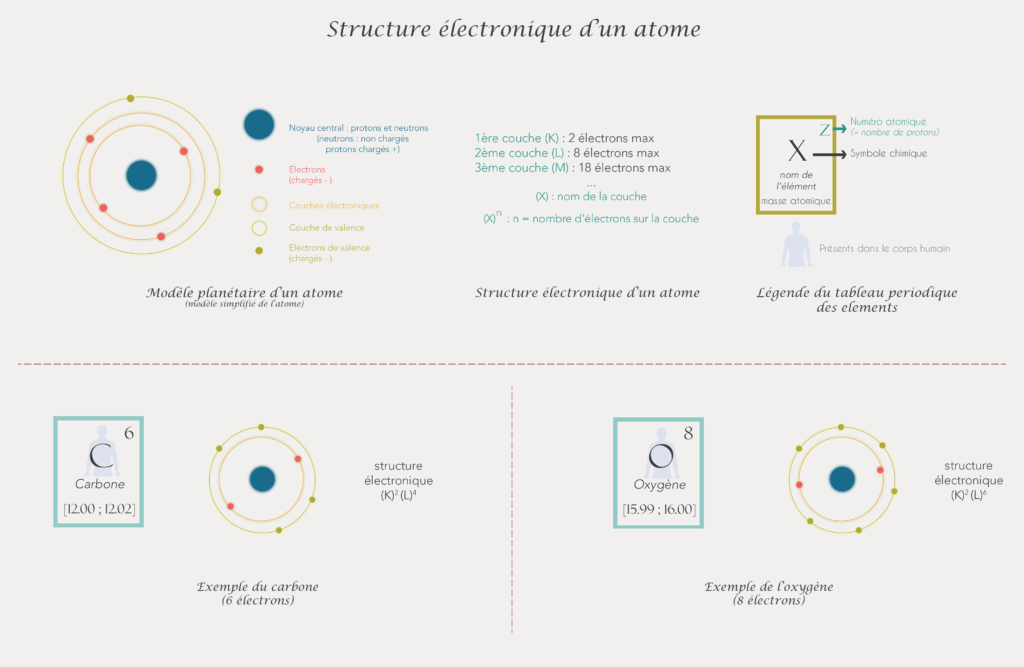
Les atomes sont constitués d’un noyau et d’électrons qui gravitent autour du noyau. Ces électrons gravitent autour du noyau dans un nuage électronique et sont « répartis » sur différentes couches (les couches électroniques). Pour être stable, un atome doit avoir 2 ou 8 électrons sur sa couche la plus externe. Pour cela il va se lier à d’autres atomes d’une manière ou d’une autre pour former une molécule.
Pour avoir un peu plus d’informations sur un atome (nombre d’électrons par exemple), il faut regarder le tableau périodique des éléments ou tableau de Mendeleïev.
On va voir ensemble comment sont représentées les molécules, comment les atomes se lient entre eux pour former des molécules puis comment les molécules se lient et interagissent entre elles.
Si vous n’avez pas le temps de rester sur la page voici le document au format pdf qui reprend tout ce qu’il y a dans cet article. En cas de problème pour avoir le fichier, vous pouvez me contacter et je vous l’enverrai avec plaisir : contact@fantabio.fr
Représentation d'une molécule
Les formules brute, semi-développée et développée
Il existe beaucoup de façons de représenter une molécule qui nous donne plus ou moins d’information sur la molécule : La formule brute, la formule semi-développée, la formule développée et la formule typographique, la représentation de Lewis, la représentation de CRAM etc…
Pour commencer, les plus simples sont les formules brutes, semi-développées et développées.
La formule brute
On a le symbole chimique du premier atome la composant suivi du symbole chimique du 2ème atome et ainsi de suite. Si la molécule contient plusieurs atomes identiques, cela est indiqué par un chiffre mis en indice. Nous n’avons aucune autre information sur la molécule avec cette formule.
Exemple
L’O2 est une molécule composée de 2 atomes d’oxygène. Le dioxyde de carbone CO2 est composé d’un atome de carbone et de 2 atomes d’oxygène. Un dernier exemple : l’eau H2O : 2 atomes d’hydrogène et un atome d’oxygène.
La formule semi-développée
Ici, la formule fait apparaitre toutes les liaisons entre les atomes sauf celles avec l’hydrogène H. Les liaisons sont représentées par des tirets entre 2 atomes.
La formule développée
Cette formule est la plus complète des trois car toutes les liaisons entre les atomes sont représentées.
Rappels sur les couches électroniques
Dans l’exemple donné ci-dessus, on remarque que tous les atomes n’ont pas le même nombre de liaisons. Les atomes de carbone C sont reliés à 4 atomes alors que les atomes d’hydrogène H sont reliés à 1 seul atome à chaque fois. Cela s’explique par le fait que le but d’un atome dans sa vie est de devenir stable et que pour être stable, ce dernier doit avoir 2 ou 8 électrons sur sa couche externe (ou couche de valence). Ce sont les règles du duet (pour les atomes ayant moins de 4 électrons en tout) et de l’octet (pour tous les autres).
Pour savoir combien d’électrons possèdent un atome sur sa couche de valence, il faut connaitre son nombre total d’électrons et retrouver sa structure électronique (c’est à dire comment sont répartis les électrons autour de l’atome).
Remarque
Le nombre d’électrons est facilement trouvable : il est égal au nombre de protons Z inscrit dans le tableau périodique des éléments.
Remarque
J'ai représenté les modèles planétaires des atomes dans l'exemple ci-dessus mais cela n'est évidemment pas nécessaire. Il faut juste savoir retrouver la structure électronique pour connaitre le nombre de liaison qu'un atome peut faire.
Un atome peut avoir jusqu’à 7 couches électroniques (pour les plus gros atomes) et chaque couche peut contenir un certain nombre d’électrons.
Le nombre maximum d’électrons par couche est égal à : 2n² avec n qui est le numéro de la couche (1ère couche, 2ème couche, 3 ème couche etc). La 1ère couche peut contenir 2 électrons, la 2ème couche peut en contenir 8 et la 3ème peut en contenir 18 etc…
Elles ont des petits noms pour les identifier : La 1ère couche : K , 2ème couche : L , 3ème couche : M, puis la couche N etc…
On peut écrire la structure électronique simplifiée des atomes grâce à ces couches en utilisant le modèle suivant : (X)Y avec X = nom de la couche et Y nombre d’électrons sur la couche X.
Remarque
Le nombre de couches dépend du nombre d'électrons que possède l'atome en question. Les couches se remplissent les unes après les autres (pour les 3 premières couches). La couche la plus externe est appelée couche de valence. Lorsque cette couche est remplie ou contient 2 ou 8 électrons, l’atome deviens stable.
Une fois que l’on a la structure électronique d’un atome et donc le nombre d’électrons qu’il a sur sa couche externe, on peut connaitre le nombre de liaisons qu’il peut faire avec d’autres atomes. En effet, ce sont les électrons de la couche la plus externe qui participent aux liaisons entre atomes. On rappelle qu’un atome pour être stable et content doit avoir 2 ou 8 électrons sur sa couche externe.
Exemple
L’atome de carbone à 6 électrons, sa structure électronique est : (K) 2 (L)4 Il a donc 4 électrons sur sa couche externe et il lui en faut 4 pour atteindre la stabilité. (8 – 4).
L’atome d’oxygène à 6 électrons sur sa couche de valence (structure électronique (K) 2 (L)6. Il lui en faut donc 2 supplémentaires pour être stable : il peut faire 2 liaisons.
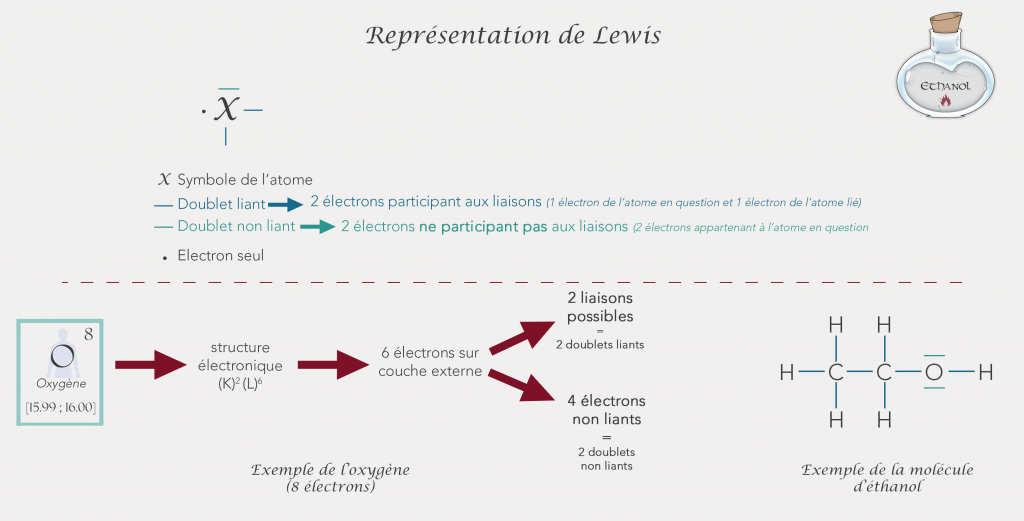
La représentation de Lewis
Dans les formules précédentes, les liaisons entre atomes sont représentées par des tirets entre 2 atomes. Dans la représentation de Lewis, on va également noter les électrons de la couche de valence qui ne participent pas aux liaisons.
On distingue alors les doublets liants et les doublets non-liants. Les doublets liants correspondent à 2 électrons liants 2 atomes entre eux. Ils sont représentés par un tiret entre les 2 atomes liés. Au contraire, les doublets non-liants sont 2 électrons ne participant pas aux liaisons entre atomes. Ils sont représentés par un tiret autour de l’atome.
Pour avoir la représentation de Lewis, on part de la formule développée et on rajoute les doublets non liants.
Remarque
Un électron seul est représenté par un point et un doublet d’électrons (deux électrons) est représenté par un tiret. Tous les atomes n'ont pas forcément de doublets non liants.
Exemple
Comme vu un peu plus haut, l’oxygène à 6 électrons de valence, parmi ces 6 électrons 2 vont participer aux liaisons avec d’autres atomes et on va représenter en plus les 4 atomes qui ne participent pas aux liaisons.
Cette représentation va nous permettre de connaitre la géométrie de la molécule. En effet, jusqu’à maintenant les formules présentées sont des représentations planes qui ne prennent pas en compte la structure 3D des molécules. Certaines représentations comme la représentation de CRAM permettent de représenter la molécule en perspective.
Les liaisons dans une molecule
On vient de voir que pour atteindre la stabilité et la zénitude les atomes se lient entre eux. Ces liaisons entre atomes sont des liaisons chimiques. Elles correspondent à un transfert ou partage d’un ou plusieurs électrons entre 2 atomes. Comme on l’a vu, les électrons mis en jeu dans les liaisons sont les électrons de valence c’est-à-dire les électrons qui sont sur la couche la plus externe de l’atome.
Les liaisons chimiques peuvent être formées ou détruites hyper rapidement (ordre d’un millionième de millionième de seconde). Certaines sont des liaisons fortes et d’autres des liaisons faibles. Cela dépend de l’énergie nécessaire pour casser ces liaisons. Une liaison forte a besoin de beaucoup d’énergie pour être cassée ou coupée par rapport à une liaison faible qui aura besoin de peu d’énergie pour être cassée.
On en distingue 3 différentes (qui vont ici des plus fortes aux plus faibles) :
Petit rappel sur les atomes
Les atomes ont des électrons (chargés négativement) qui tournent autour d’un noyau (chargé positivement). Ils ont donc une charge globale neutre.
Chaque atome peut plus ou moins attirer des électrons. On mesure leur affinité avec les électrons grâce à l’électronégativité.
Plus un atome est électronégatif et plus il attire les électrons. Au contraire, moins il est électronégatif moins il attire les électrons (plus il voudra donner ses électrons).
Remarque
On peut trouver les électronégativités des atomes dans le tableau périodique des éléments. De manière générale, les atomes les plus électronégatifs se retrouvent en haut à droite du tableau et les moins électronégatifs sont en bas à gauche.
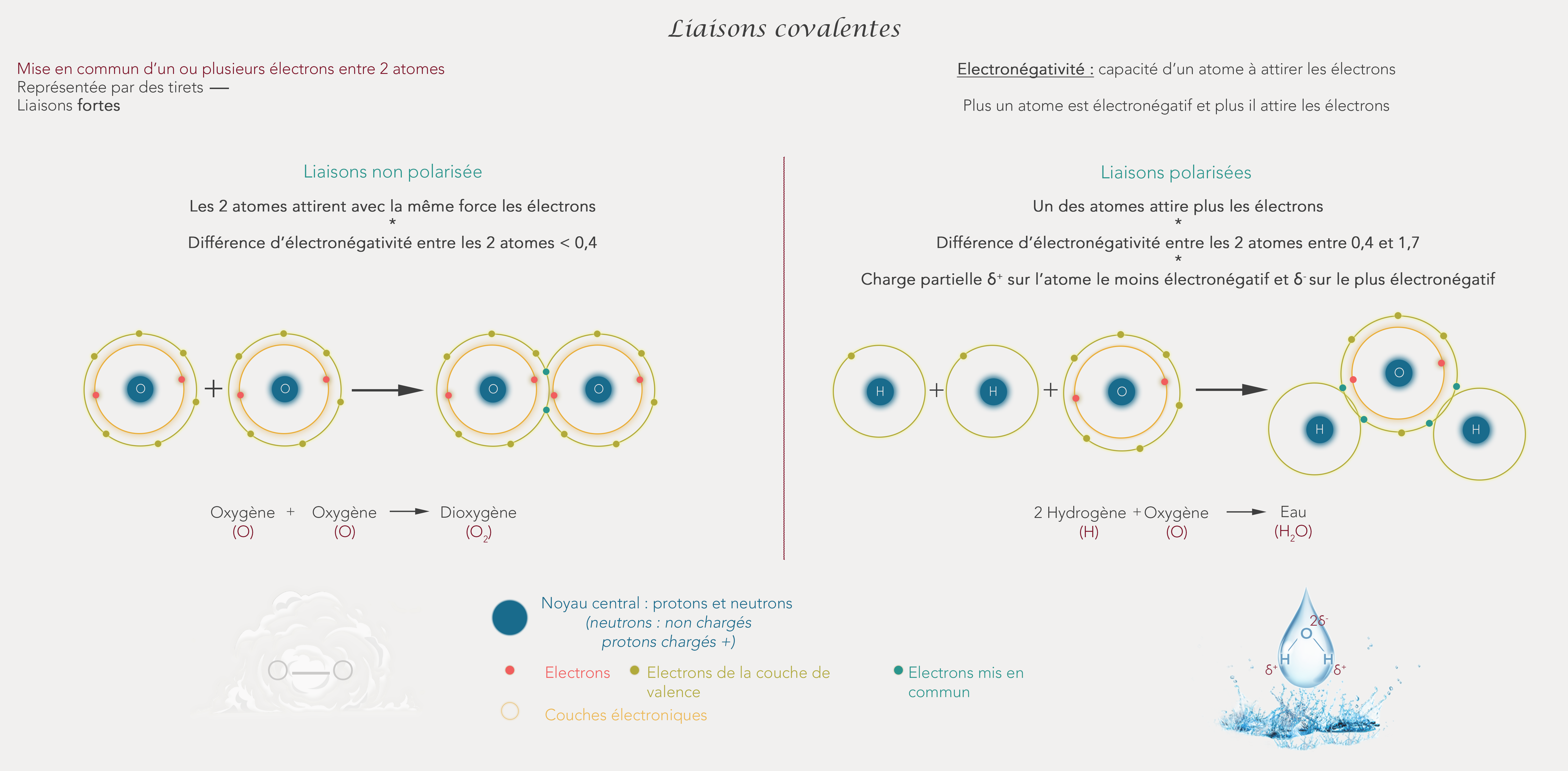
Les liaisons covalentes
Pour ces liaisons, les 2 atomes mis en jeu partagent au moins une paire d’électrons externes entre eux. Les électrons mis en commun appartiennent donc aux 2 atomes concernés. Le but étant toujours de respecter la règle de l’octet ou du duet pour atteindre une stabilité.
Les atomes peuvent partager 2, 4 ou 6 électrons entre eux. Dans ce cas, les liaisons entre les atomes sont représentées respectivement par un trait, 2 traits ou 3 traits superposés mis entre les 2 symboles chimiques. Elles se font en général entre 2 éléments qui ne sont pas des métaux.
Il s’agit de liaisons fortes car il faut beaucoup d’énergie pour les briser. De plus, il existe 2 types de liaisons covalentes :
- Liaisons covalentes non polarisées
- Liaisons covalentes polarisées ou liaisons polarisées
Liaisons covalentes non polarisées
Elle se crée entre 2 atomes qui ont une électronégativité proche. La différence entre les 2 électronégativité des atomes doit être inférieure à 0.4.
Exemple
Une molécule de dioxygène O2 va avoir une liaison covalente entre ses atomes d'oxygène.
Liaisons polarisées
Elle se fait entre 2 atomes qui ont une différence d’électronégativité comprise entre 0,4 et 1,7.
Ici un des atomes attirent un peu plus les électrons que l’autre. Ainsi les électrons mis en commun auront tendance à se promener un peu plus autour de l’atome le plus électronégatif (donc celui qui attire le plus les électrons).
Ainsi on va se retrouver avec ce que l’on appelle une charge partielle sur les atomes concernés par la liaison. Cette charge partielle se note delta δ. On notera un petit δ – à côté de l’atome le plus électronégatif et δ + à coté l’atome le moins électronégatif.
Exemple
Une molécule d'eau H2O va avoir une liaison polarisée entre son atome d'oxygène et ses atomes d'hydrogène. L'atome d'oxygène étant plus électronégatif que les atomes d'hydrogène, celui-ci portera la charge partielle négative et les atomes d'hydrogène porteront une charge partielle positive.
Remarque
Une molécule est polarisée à partir du moment où elle a une liaison polarisée. On dit que c'est une molécule polaire.
Par exemple, l’éthanol (que l'on a vu au début) est une molécule polarisée : elle contient une liaison polarisée entre un atome d’oxygène et un atome d’hydrogène (comme l’eau).
Remarque
Si la différence d'électronégativité est supérieure à 1,7 les électrons vont être totalement attirés vers l'atome le plus électronégatif. La liaison devient alors une liaison ionique (vue juste après).
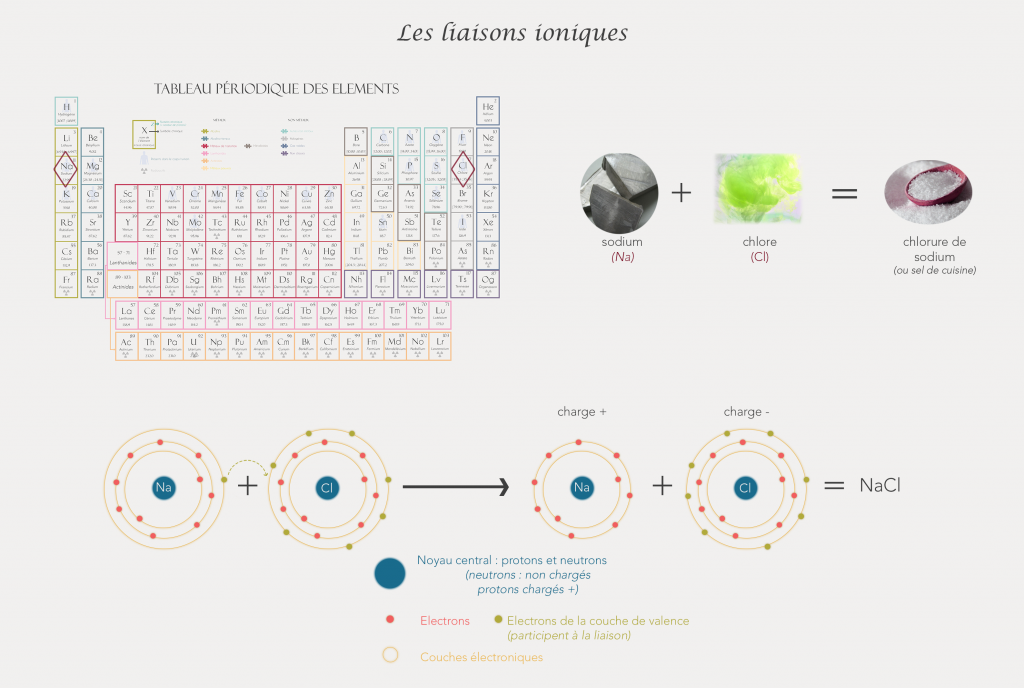
Les liaisons ioniques
Elles se forment quand un atome donne ou prend un électron à un autre atome. La différence d’électronégativité entre les 2 atomes est supérieure à 1,7 (un des 2 atomes attire fortement les électrons de l’autre atome).
Les 2 atomes mis en jeu deviennent des ions (un chargé positivement (il a perdu un ou des électrons) et un négativement (il a gagné un ou plusieurs électrons) et s’attirent mutuellement (les charges opposées s’attirent) (ils font copain copain).
Elles ont une force intermédiaire mais reste des liaisons assez fortes.
Exemple
Un exemple donné souvent est le sel de cuisine : NaCl ou chlorure de sodium. Il est composé d’un ion Na+ et d’un ion Cl-. (Ici la molécule est composée de 2 ions dont les charges s’annulent et donc elle est neutre).
Rappelons-nous que les atomes sont stables si leur couche de valence (dernière couche d’électrons de l’atome) contient 8 électrons (règle de l’octet).
L’atome de sodium contient 11 électrons : il y en a 2 sur sa 1ère couche électronique, 8 sur sa 2ème et 1 seul (tout seul et triste) sur sa 3ème couche (la couche de valence de l’atome).
L’atome de chlore lui contient 17 électrons : il en a 2 sur sa 1ère couche électronique, 8 sur sa 2ème et 7 sur sa 3ème (il en manque donc 1 pour arriver à 8).
Ce qui va se passer quand un atome de chlore et un atome de sodium vont se croiser c’est que l’électron solitaire du sodium va aller faire un tour chez le chlore (qui lui va être content d’avoir un nouveau pote). Ainsi, l’ion sodium sera stable (2ème couche devient sa couche de valence respecte la règle de l’octet car contient 8 électrons) et l’ion chlorure sera aussi stable (3ème couche respecte la règle de l’octet) et tout le monde est content.
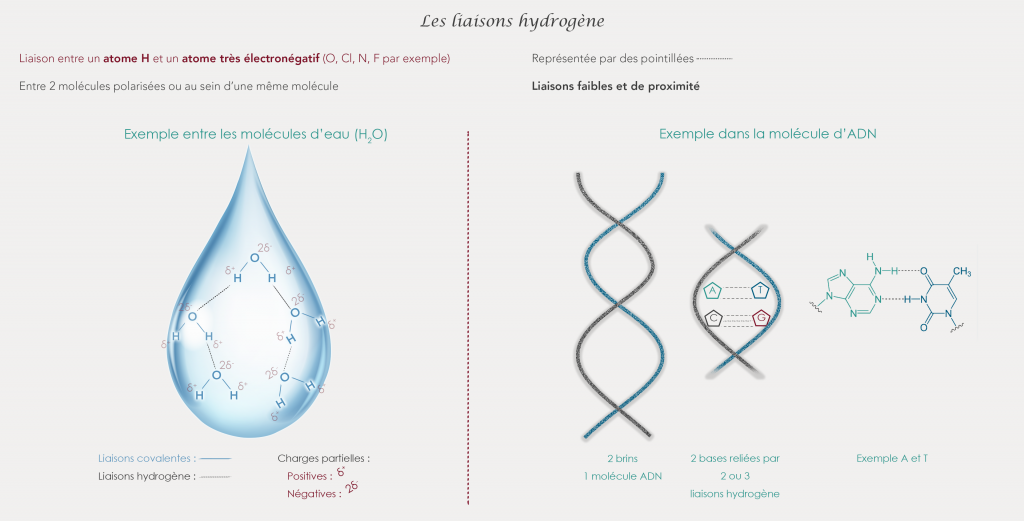
Les liaisons hydrogène
Les liaisons hydrogène se forment entre un atome d’hydrogène et un atome très électronégatif. Cela peut être un atome d’oxygène, de chlore, d’azote ou de fluor par exemple.
Elle peut lier 2 atomes au sein d’une même molécule ou de 2 molécules polarisées différentes. Elle est représentée par des pointillées entre les 2 atomes impliqués dans la liaison.
Ce sont des liaisons très communes et fondamentales pour la vie. Ce sont des liaisons très faibles et de proximité
Exemple
On les retrouve notamment dans l’eau, elles permettent de relier les molécules d’H2O entre elles, mais aussi dans l'ADN qui est une très très grosse molécule pour stabiliser sa structure.
Les liaisons entre molecules
Comme nous venons de le voir, les molécules peuvent se lier entre elles (et heureusement !). Pour cela différentes manières s’offrent à elles :
- Les liaisons hydrogène que l’on vient de voir
- Les forces de Van Der Waals
Pour mieux comprendre les forces de Van der Waals et les interactions entre molécules, il est d’abord important de présenter qu’il existe 2 grands types de molécules : les molécules polaires et les molécules apolaires.
Les molécules polaires et apolaires
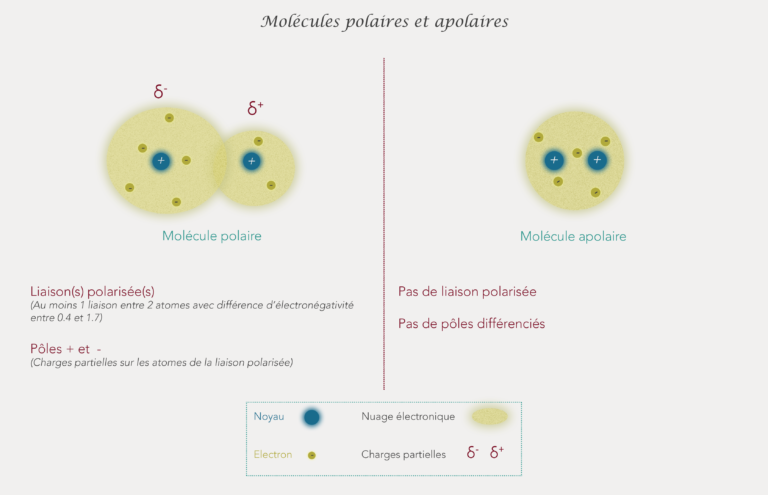
Les électrons tournent de manière aléatoire autour des atomes dans un nuage électronique (nuage simplifié dans les illustrations données jusqu’à maintenant). Les atomes ont une certaine capacité pour attirer les électrons. Cette capacité est nommée électronégativité. Plus un atome est électronégatif et plus il va attirer les électrons.
Comme vu précédemment, si une liaison se fait entre 2 atomes qui ont une différence d’électronégativité comprise entre 0.4 et 1.7, on dit que la liaison est polarisée. Un des atomes de la liaison attire donc un peu plus les électrons que l’autre : les électrons vont tourner un peu plus autour de l’atome le plus électronégatif. Cela va créer des charges partielles entre les 2 atomes et le nuage électronique va alors légèrement changer : et on va alors avoir un pôle négatif et un pôle positif. Le pôle négatif sera du côté de l’atome le plus électronégatif et le pôle positif sera autour de l’autre atome.
Si une molécule contient au moins une liaison polarisée alors c’est une molécule polaire (on verra les exceptions plus tard).
Si une molécule n’a pas de liaison(s) polarisée(s) cela veut dire que c’est une molécule apolaire (a : absence). Les électrons sont attirés de la même façon par les atomes et donc tournent autour d’eux sans préférence pour l’un ou l’autre.
Exemple
L’eau que l’on a vue précédemment est une molécule polaire donc un dipôle ou dipôle permanent. L’éthanol comme tous les alcools est aussi une molécule polaire.
Remarque
La molécule totale reste neutre. C’est juste le fait que les électrons sont plus attirés vers un atome par rapport à l’autre qui fait que les 2 atomes sont chargés partiellement.
Les forces de Van Der Waals
Ce sont des forces qui permettent aux molécules de se lier entre elles. Ce sont des forces faibles et de proximité : il faut que les molécules soient très proches pour qu’elles puissent se lier comme ça et il faut très peu d’énergie pour les briser.
Par rapport aux liaisons vu précédemment, ici se sont des liaisons électrostatiques : ce sont les charges opposées des molécules qui s’attirent mutuellement (comme un aimant).
On en distingue 3 différentes selon les molécules impliquées :
- Les forces dipôle-dipôle (ou forces de Keesom) : interaction entre 2 molécules polaires
- Les forces dipôle induit-dipôle (ou forces de Debye) : interaction entre une molécule polaire et une molécule apolaire
- Les forces dipôle induit-dipôle induit (ou forces de London) : interaction entre 2 molécules apolaires
Remarque
Un dipôle ici est une molécule polaire (aussi appelé molécule polarisée).
Les forces dipôle-dipôle / interaction entre 2 molécules polaires :
Les forces dipôle-dipôle ou forces de Keesom font que 2 molécules polaires proches s’attirent : les charges partielles opposées s’attirant mutuellement.
Les forces dipôle induit-dipôle / interaction entre 1 molécule polaire et 1 molécule apolaire :
Un dipôle induit est une molécule apolaire qui se polarise (elle devient polaire) lorsqu’elle se rapproche d’une molécule polaire. Cette polarisation n’est pas définitive du tout : si les 2 molécules s’éloignent, la molécule redeviens apolaire.
Remarque
La molécule apolaire se polarise du fait que la charge partielle positive existante de la molécule polaire va attirer ses électrons et donc cela va créer une charge partielle négative là où les électrons auront plus tendance à aller et une charge partielle positive là où ils vont moins.
Les forces dipôle instantané-dipôle instantané / interaction entre 2 molécules apolaires
Ici il s’agit d’interaction entre 2 molécules apolaires.
Vu que les électrons se déplacent aléatoirement autour des atomes, il arrive qu’ils se retrouvent à un temps donné un peu plus près d’un atome que de l’autre. Cela créé au temps t donné une charge partielle sur les atomes comme pour les molécules polaires. Elle peut ainsi attirer d’autres molécules qui seraient présentes autour d’elle.
A RETENIR
Les molécules sont un enchainement d’atomes liés les uns aux autres. (Ces atomes peuvent être identiques ou différents.) Les liaisons qui lient les atomes entre eux sont des liaisons chimiques c’est-à-dire que c’est un transfert ou partage d’électrons entre 2 atomes. Il existe 3 types de liaisons différentes qui peuvent être plus ou moins fortes : (ici de la plus forte à la plus faible) :
Les molécules peuvent également interagirent entre elles. Cela est possible grâce aux liaisons hydrogène vu au-dessus et aux forces de Van der Waals. Pour les forces de Van der Waals, ce sont les charges partielles des molécules qui s’attirent (comme un aimant, les charges opposées s’attirent). Il en existe 3 différentes selon si les molécules qui interagissent sont polaires ou apolaires. Ici se sont des interactions faibles et de proximité.
On peut représenter les molécules de différentes manières : en utilisant les formules brutes, semi-développées ou développées mais aussi en utilisant des représentations de Lewis plus complète ou des représentations de CRAM pour connaitre la géométrie de la molécule.
Maintenant que vous savez tout cela, vous pouvez continuer votre voyage au cœur de la chimie avec l’article suivant :