Les atomes
Pour commencer le voyage dans le monde du vivant nous allons devoir faire un peu de chimie. En effet, la chimie est la base (hyper méga importante) pour comprendre le fonctionnement de notre corps.
INTRODUCTION
L’ensemble de notre corps et de ce qui nous entoure est constitué de ce qu’on appelle des éléments. C’est ce qu’il reste quand on coupe en minuscules morceaux une chose vivante ou non (un humain ou un bâton de bois par exemple). Il est impossible de les dégrader en substances plus simples au moyen de méthodes chimiques ordinaires. Il en existe 118 différents qui sont rassemblés dans le tableau périodique des éléments (ou tableau de Mendeleïev). Parmi ces 118 éléments certains sont présents dans la nature et d’autres ont été créés par l’Homme.
Exemple
L’hydrogène, l’oxygène, le fer ou l’or sont des exemples d'éléments.
Un élément chimique est un ensemble ou groupe d’atomes qui ont le même nombre de protons dans leur noyau. Je vous invite à aller voir à quoi ressemble un atome, les variations possibles qu’un atome peut avoir et enfin le tableau réunissant tous les éléments connus : le tableau périodique des éléments.
Si vous n’avez pas le temps de rester sur la page voici le document au format pdf qui reprend tout ce qu’il y a dans cet article. En cas de problème pour avoir le fichier, vous pouvez me contacter et je vous l’enverrai avec plaisir : contact@fantabio.fr
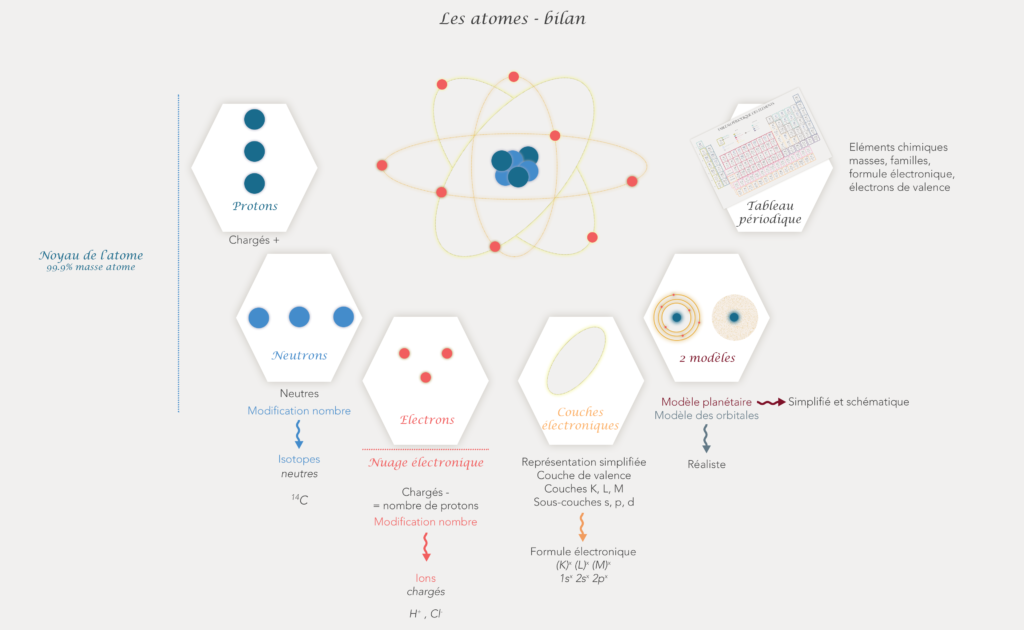
La structure d'un atome
Structure générale
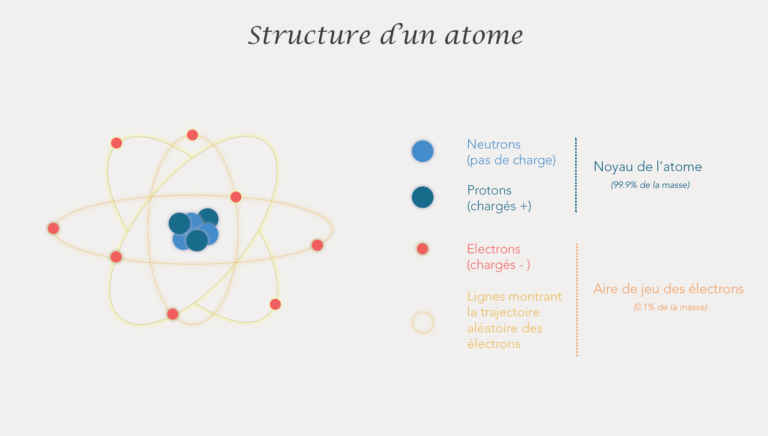
Un atome est constitué de neutrons, protons et électrons. On les différencie par la place qu’ils ont dans l’atome, leur charge électrique et leur masse.
Ainsi les neutrons et les protons constituent le noyau central de l’atome et les électrons orbitent (ils tournent en mode aléatoire et très très vite) autour de ce noyau.
Au niveau des charges, les protons sont chargés positivement et les neutrons sont neutres comme leur nom l’indique. Les électrons sont eux chargés négativement. L’atome est une particule neutre : il contient autant de charges positives que de charges négatives. En pratique cela signifie qu’il a le même nombre de protons et d’électrons.
Au niveau de la masse on considère que le noyau (donc les protons et neutrons), représentent 99.9% de la masse de l’atome. La masse des électrons est donc négligeable. De plus, un neutron et un proton ont a peu près la même masse.
Les différentes représentations possibles
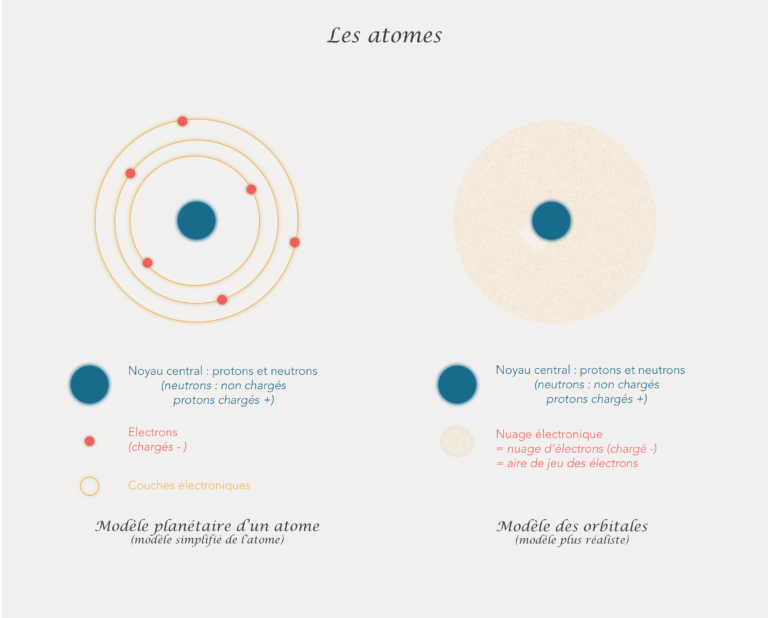
La représentation et la compréhension de l’atome ont évolué au fil du temps. Aujourd’hui on peut schématiser un atome avec 2 modèles : le modèle planétaire et celui des orbitales. Une représentation plus symbolique est aussi utilisée plus facilement.
Les modèles :
- Le modèle planétaire : est une version simplifiée
- Le modèle des orbitales : plus proche de la réalité
Le modèle planétaire est plus facile à comprendre mais aussi plus éloignée de la réalité. Les électrons ici circulent sur des couches électroniques qui sont représentées par des lignes circulaires autour du noyau. C’est ce modèle que j’utiliserai le plus souvent pour la suite.
Dans le modèle des orbitales, les électrons circulent dans un nuage électronique autour du noyau. Ce modèle est plus réaliste car, en réalité, les électrons tournent de manière aléatoire autour du noyau et ne suivent pas de trajectoires définie.
On peut également représenter schématiquement un atome (c’est ce qui est le plus utilisé évidemment en routine).
Dans cette représentation on a le symbole de l’élément X et 2 chiffres A et Z.
- A est le nombre de masse et correspond au nombre de nucléons que contient l'atome. Les nucléons sont les neutrons + les protons du noyau.
- Z est le numéro atomique qui correspond au nombre de protons de l'atome.
Variations possibles
Comme dis en introduction, un élément est un ensemble d’atomes qui contiennent le même nombre de protons. Si le nombre de protons est modifié, alors on change d’élément.
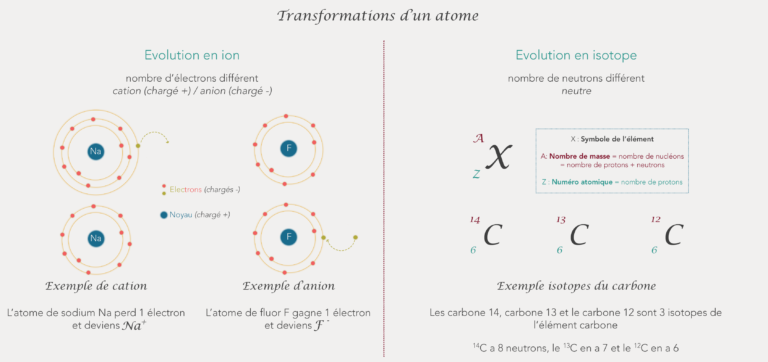
Ainsi, un atome peut subir quelques variations : il peut perdre ou gagner des électrons ou des neutrons. Il deviens alors un ion ou un autre atome.
Gain ou perte d'électrons
Si un atome gagne ou perd un ou plusieurs électrons, il deviens un ion.
Un ion est chargé soit positivement soit négativement. En effet, si l’atome perd un électron, il perd une charge négative (les électrons étant chargés négativement) et il y a donc plus de charges positives (le nombre de protons qui sont chargés + ne changeant pas). A l’inverse, si l’atome gagne un électron, il gagne une charge négative et deviendra un ion chargé négativement.
Cette charge est notée en exposant à côté du symbole chimique.
Un ion chargé positivement est un cation et un ion chargé négativement est un anion.
Exemple
H + est un cation et Cl - est un anion
Gain ou perte de neutrons
Si deux atomes ont un nombre différent de neutrons on dis que ce sont 2 isotopes. Ici, le nombre de protons et d’électrons reste le même. Un élément peut avoir plusieurs isotopes (pas que 2). Certains sont stables et d’autres non.
Pour l’écriture ou la représentation d’un isotope, on aura le même symbole chimique et le même numéro atomique mais un nombre de masse qui variera selon le nombre de neutron(s) ajouté(s) ou supprimé(s).
Ce sont 2 atomes différents qui se ressemblent (comme des sosies.)
Remarque
Pour simplifier l’écriture au quotidien, on note juste le symbole de l’élément et le nombre de masse A
Exemple
Le carbone 14 ( 14 C) et le carbone 12 ( 12C) sont 2 isotopes de l'élément carbone.
structure electronique
Les couches électroniques
Ce sont des zones autour du noyau de l’atome dans lesquelles sont répartis les électrons.
Il peut y avoir jusqu’à 7 couches électroniques pour les plus gros atomes. Chaque couche peut contenir un certain nombre d’électrons. Le nombre max d’électrons par couche est égal à : 2n² avec n qui est le numéro de la couche ( couche 1, couche 2 etc). La 1ère couche peut contenir 2 électrons, la 2ème couche peut en contenir 8 et la 3ème peut en contenir 18 etc…
Elles ont des petits noms pour les identifier : La 1ère couche : K , 2ème couche : L , 3ème couche : M, puis la couche N etc…
Le nombre de couches dépend du nombre d’électrons que possède l’atome en question.
Couche de valence
Les couches se remplissent les unes après les autres (pour les 3 premières couches). La couche la plus externe est appelée couche de valence. Lorsque cette couche est remplie ou contient 2 ou 8 électrons, l’atome deviens stable.
Les électrons se trouvant sur cette couche sont appelés des électrons de valence. Ils sont très importants car ce sont eux qui participent notamment aux liaisons chimiques que l’on verra dans la partie « molécule »
Remarque
Quand une couche est complète on dit qu'elle est saturée.
Les sous-couches électroniques
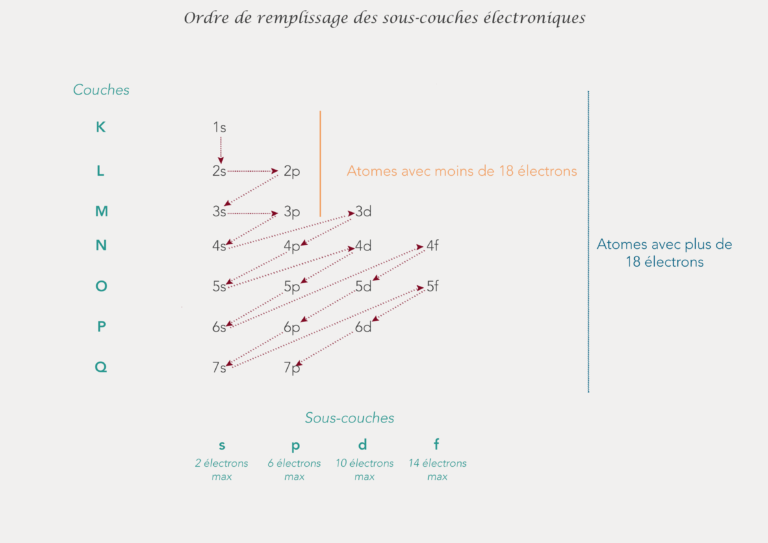
Parce que si c’était aussi simple ce ne serait pas drôle, ces couches électroniques ont des sous couches. Ces sous-couches sont aussi appelées des orbitales.
- La couche K a 1 seule sous-couche ; 1s,
- La couche L a 2 sous-couches : 2s et 2p,
- La couche M a 3 sous-couches : 3s, 3p et 3d.
Le numéro devant la sous-couche est le numéro de la couche à laquelle elle appartient.
Le nombre d’électrons qu’une sous-couche contient est noté en exposant à coté de la lettre correspondante.
Les sous couches s peuvent accueillir 2 électrons, les sous couches p peuvent en accueillir 6 et la sous-couche d peut en accueillir 10. Elles se remplissent selon les règles de Klechkowski.
Remarque
Ce serait trop long ici d'expliquer le pourquoi du comment et cela nous importe peu en biologie. L'important est de pouvoir retrouver facilement le nombre d'électrons de valence d'un atome ainsi que de savoir/comprendre l'ordre de remplissage pour les plus petits atomes.
Formule électronique
On peut écrire la formule électronique des atomes grâce à ces couches ou sous-couches.
Formule électronique simplifiée
C’est la formule électronique qui utilises les couches électroniques. On a différentes manières de la noter :
- (X) Y
- X Y
Avec X : nom de la couche et Y nombre d’électrons de la couche X
Exemple
L'oxygène qui a 8 électrons (cf tableau périodique plus bas) a pour structure électronique simplifiée : (K) 2 (L) 6
Formule électronique complète
Ici, on décrit le nombre d’électrons de chaque sous-couche. Comme pour la formule simplifiée, le nombre d’électrons que contient une sous-couche est notée en exposant.
Exemple
L'oxygène qui a toujours 8 électrons a pour structure électronique complète : 1s² 2s² 2p 4
Les électrons de valence sont toujours ceux se trouvant sur la dernière couche (et pas sur la dernière sous-couche).
Exemple
L'oxygène qui a encore 8 électrons a 6 électrons de valence
Le tableau periodique des elements
Maintenant que nous avons ces notions on va pouvoir se poser un peu plus sur le tableau de Mendeleïev dont je parlais un peu plus tôt.
Ce tableau regroupe tous les éléments chimiques connus à ce jour.
Les éléments chimiques
Ils sont classés dans l’ordre dans des cases individuelles. Dans ces cases on a différentes informations :
- Le symbole chimique et le nom de l'élément
- Le numéro atomique qui correspond au nombre de protons présents dans les atomes de l'élément. C'est un nombre entier,
- La masse atomique , inscrite en petit. Il s’agit de la moyenne des masses atomiques de tous les isotopes existants, pour un élément donné, selon leur abondance dans la nature.
Remarque
J'ai aussi précisé dans mon tableau, les éléments présents dans le corps humains et les éléments radioactifs. Ce n'est pas précisé dans tous les tableaux que vous pouvez trouver. Dans d'autres tableaux vous pourrez aussi trouver d'autres informations que celles que j'ai mise ici.
Les lignes et les colonnes
Le tableau périodique contient 7 lignes que l’on appelle des périodes. Elles correspondent au nombre de couches électroniques que possède les atomes de l’élément. Les éléments de la première ligne ont 1 couche électronique, ceux de la ligne 2 en ont 2 etc…
Le numéro de la colonne (si l’on ne tiens pas compte des métaux de transition qui sont entre la 3ème et la 12ème colonne) correspond au nombre d’électrons présents sur la couche de valence (dernière couche électronique).
Exemple
L'oxygène est sur la 2ème ligne et est dans la 6ème colonne. Il a donc 2 couches électroniques et 6 atomes sur sa couche de valence.
Les blocs
On peut également diviser le tableau en 4 blocs, correspondants aux dernières sous-couches remplies (ou en cours de remplissage) des atomes.
- Le bloc s : Les 2 premières colonnes et l'hélium correspondent au bloc s. La dernière sous-couche occupée des atomes de ces colonnes est de type s.
- Le bloc p qui comprends les 6 dernières colonnes. La dernière sous-couche occupée est une sous-couche p.
- Le bloc d : Ce bloc contient tous les métaux de transitions (colonnes 3 à 12). La dernière sous-couche occupée des atomes de ces colonnes est de type d.
- Le bloc f : Il ne reste ici que les lanthanides et les actinides. Leur dernière sous-couche occupée est de type f.
Exemple
L'oxygène est dans la 6ème colonne. Sa dernière sous-couche occupée est la sous-couche p (comme vu précédemment).
L'électronégativité
Le tableau nous donne aussi des informations sur l’électronégativité d’un atome. L’électronégativité est une mesure qui permet de savoir la capacité d’un atome à attirer (ou pas) un électron vers lui. Plus un atome est électronégatif et plus il va attirer les électrons. Au contraire, moins il est électronégatif et plus il va avoir tendance à donner ses électrons. (On parle ici des électrons de sa couche de valence). Sur le tableau : les atomes les plus électronégatifs se retrouvent en haut à droite et les moins électronégatifs sont en bas à gauche.
Cela sera utile pour la suite.
Exemple
Le Francium est l'élément le moins électronégatif et le Fluor est le plus électronégatif. L'oxygène est plus électronégatif que le carbone et l'hydrogène est plus électronégatif que le sodium. L'électronégativité des différents éléments a été mesurée et se retrouvent dans l'échelle de Pauling.
Sur les 118 éléments connus, une 20aine environ composent le corps humain dont 4 en majorité (environ 96% de notre composition) : l’oxygène, le carbone, l’hydrogène et l’azote. Les autres comme le calcium ou le sodium sont présents en plus petite quantité.
Remarque
Une partie d'entre eux sont présents à l'état naturel et d'autres sont issus de réactions nucléaires.
RESUME DU VOYAGE DANS LE PAYS DES ATOMES
Les atomes peuvent se regrouper pour former des molécules comme l’eau (H2O), ou le dioxygène (O2). C’est la suite du voyage.